Как сжечь углекислый газ? | Наука и жизнь
Новые катализаторы помогут превратить диоксид углерода в топливо.
Чтобы получить энергию, как правило, необходимо что-нибудь сжечь: обычные автомобили сжигают топливо в двигателях внутреннего сгорания, электромобили заряжают свои батареи от электричества, поступающего, например, на ТЭЦ, где сжигают природный газ, и даже нам для мышечной или умственной работы надо «сжечь» внутри себя съеденный завтрак.
Пористая структура поверхности серебряного катализатора после удаления полистирольной матрицы. (Фото: MIT)
Открыть в полном размере
‹
›
В любом органическом топливе, будь то бензиновые углеводороды или углеводы из шоколадки, содержатся атомы углерода, которые в конце своего энергетического пути превращаются в углекислый газ. Ну а газ, в свою очередь, отправляется в атмосферу, где он может накапливаться и вызывать всякие нехорошие эффекты вроде глобального потепления.
С энергетической точки зрения углекислый газ абсолютно бесполезен, поскольку углерод в нём полностью «сгорел», прочно и неразрывно связав себя с двумя атомами кислорода. Гореть он уже не горит, и единственное что с ним можно сделать – утопить или закопать. Утопить его можно, растворив в океане – и это действительно один из способов утилизации СО2. Другой способ – закачать его под высоким давлением под землю, желательно там, где есть нефтяные месторождения; это позволит повысить отдачу нефтяных пластов и поможет добыть больше нефти. Однако химики всё же нашли способ «сварить кашу из топора» – существует третий путь утилизации СО2, когда его превращают в топливо.
Чтобы превратить СО2 в топливо, нужно «похимичить» с молекулой углекислого газа, например, отобрать у неё один атом кислорода. Тогда углекислый газ превратится в угарный газ СО. Несмотря на то, что для большинства угарный газ – это «тот газ, от которого периодически погибают неаккуратные пользователи дровяных печей», в промышленности его используют в самых разных процессах: во-первых, его можно сжечь и получить энергию, во-вторых, его можно использовать в металлургических процессах, а в-третьих, из него можно синтезировать различные органические молекулы, в том числе и жидкое топливо.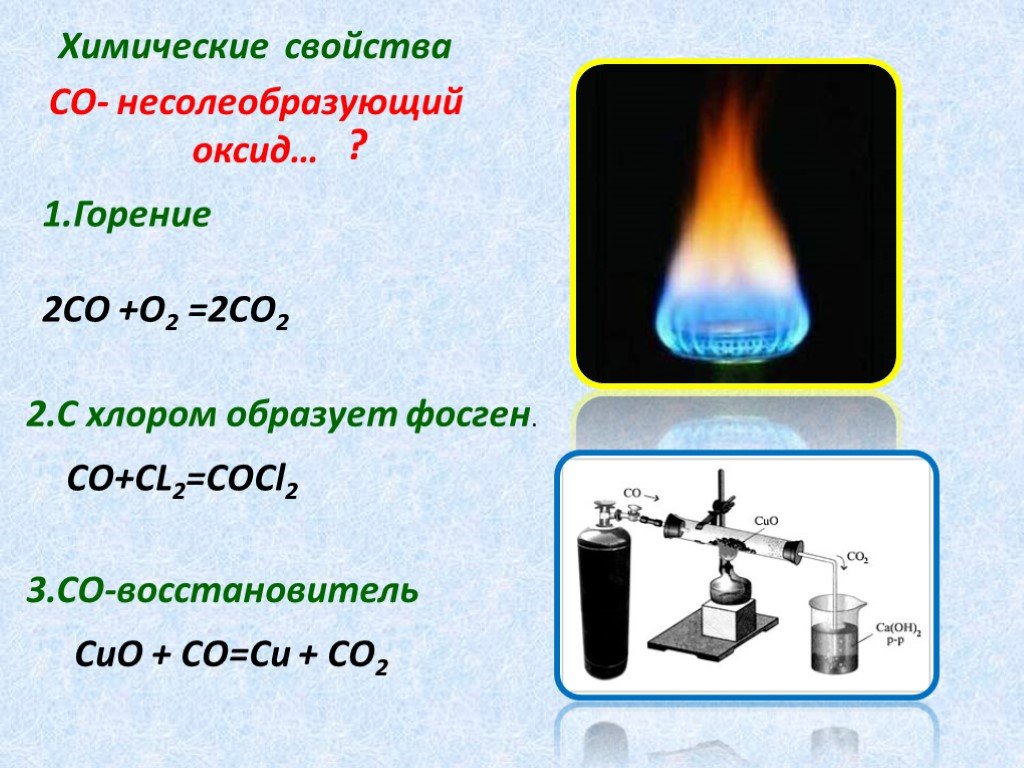 Как раз последний пункт и открывает перед углекислым газом нефтехимические перспективы.
Как раз последний пункт и открывает перед углекислым газом нефтехимические перспективы.
Однако стоит заметить, что использование угарного газа в химических целях не есть что-то совсем новое. Ещё на заре ХХ века германские химики Франц Фишер и Ганс Тропш разработали способ, как из обычного угля получить жидкое топливо: сначала из каменного угля и воды получают синтез-газ – так называется смесь угарного газа и водорода, а затем с помощью катализатора из синтез-газа получают различные углеводороды. Этот способ был востребован, когда обычной нефти не хватало, однако со временем, во второй половине двадцатого века метод получения топлива из угля стала просто дорогой альтернативой «классическим» нефтеперерабатывающим технологиям. Но если в процессе Фишера-Тропша в качестве сырья используют каменный уголь, который сам по себе есть полезное ископаемое, то химики из Массачусетского технологического института для той же цели – получения синтез-газа – разработали способ, позволяющий делать его из «ненужного» углекислого газа.
Такие вещи невозможны без использования катализаторов, и, чтобы получить работающий катализатор, химикам порой приходится идти на самые разные хитрости. Дело в том, что, кроме определённого химического состава, для катализатора очень важна его внутренняя структура. Если говорить упрощённо, катализатор, нанесённый на ровную поверхность, может оказаться нерабочим, а вот если его нанести на пористую поверхность, и если у пор при этом будет определённый размер, то тогда он сможет заработать в полную силу.
Для того чтобы создать такой катализатор, химики взяли электропроводящий материал в качестве подложки и нанесли на него слой из полистирольных шариков диаметром около 200 нанометров. После чего пустоты, оставшиеся в пространстве между шариками, заполнили атомами серебра. (В качестве аналогии можно представить, что мы насыпали на пол слой из бильярдных шаров, а потом всё сверху залили ровным слоем расплавленного парафина.) Теперь, чтобы получить пористый субстрат, нужно каким-то образом убрать из материала все шарики, оставив в целости оставшуюся структуру. В случае с бильярдными шарами это было бы весьма проблематично, а вот в случае с полистирольными шариками все оказалось намного проще – и в итоге после удаления полистирола на поверхности электрода получилась ячеистая структура из серебра с «сотами» определённого размера.
В случае с бильярдными шарами это было бы весьма проблематично, а вот в случае с полистирольными шариками все оказалось намного проще – и в итоге после удаления полистирола на поверхности электрода получилась ячеистая структура из серебра с «сотами» определённого размера.
Подобный материал, как оказалось, хорошо превращает углекислый газ в синтез-газ, причём эффективность и селективность катализатора управляется за счёт размера сот: если на этапе синтеза катализатора взять полистирольные шарики покрупнее, то после реакции получится один состав продуктов, а если помельче – то другой. Подробно результаты исследований опубликованы в журнале Angewandte Chemie.
И вроде бы всё хорошо, и человечество должно бы праздновать победу над выбросами парниковых газов, а каждую трубу, чадящую в атмосферу продуктами сгорания, нужно оборудовать подобным серебряным катализатором, но всё-таки стоит сделать одно замечание. Один из важных законов, по которому живёт окружающий нас мир – закон сохранения: масса и энергия не возникают ниоткуда и не пропадают в никуда. Это справедливо и для атомов химических элементов, и для тепла, вырабатываемого при сжигании топлива, и для электрической энергии. Поэтому сколько энергии получается при сжигании угарного газа до углекислого, как минимум, столько же энергии нужно затратить (упрощённо), чтобы превратить молекулу углекислого газа обратно в молекулу угарного. И очевидно, что для такой, в общем-то, «зелёной» технологии по утилизации парникового газа нужен свой источник энергии, который как минимум не «начадил» бы в атмосферу столько СО2, сколько можно было бы превратить в полезный продукт.
Это справедливо и для атомов химических элементов, и для тепла, вырабатываемого при сжигании топлива, и для электрической энергии. Поэтому сколько энергии получается при сжигании угарного газа до углекислого, как минимум, столько же энергии нужно затратить (упрощённо), чтобы превратить молекулу углекислого газа обратно в молекулу угарного. И очевидно, что для такой, в общем-то, «зелёной» технологии по утилизации парникового газа нужен свой источник энергии, который как минимум не «начадил» бы в атмосферу столько СО2, сколько можно было бы превратить в полезный продукт.
Откуда взять энергию для превращения одного газа в другой? Например, от ветряных или солнечных энергоустановок, которые производят энергию, но не выбрасывают в атмосферу продукты сгорания топлива – в результате это позволило бы уменьшить общее количество углекислого газа.
Забавно, что похожей деятельностью занимались древние растения и бактерии, поглощавшие находившийся тогда в избытке в атмосфере углекислый газ, и преобразовывшие его в органические вещества, ставшие потом ископаемым топливом. Возможно, что человечеству в будущем придётся заниматься чем-то похожим, но только уже с использованием химических технологий.
Возможно, что человечеству в будущем придётся заниматься чем-то похожим, но только уже с использованием химических технологий.
Угарный газ, CO, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
бытовая химия — Как в процессе горения образуется окись углерода?
спросил
Изменено
5 лет, 8 месяцев назад
Просмотрено
849 раз
$\begingroup$
Мой вопрос связан с безопасностью нагревателей внутреннего сгорания. Я хочу определить механизм образования CO и, надеюсь, иметь дополнительное понимание и подсказки к предупреждающим знакам для выявления небезопасных печей или установок. Основными мерами безопасности всегда будут детекторы угарного газа и хорошая вентиляция.
Худшие истории ужасов обычно связаны с барбекю на углях в замкнутых пространствах – твердый углерод горит при температуре около 900 °C. Можно ли с уверенностью предположить, что основным продуктом сгорания здесь является CO, который не может полностью сгореть до CO 2 при пониженном уровне кислорода? Или работает более сложный процесс?
Каким образом желтое горение жидкого или газового пламени приводит к образованию CO? Это просто вопрос плохого потока газа в дымоходе и обедненного кислорода в поступающем воздухе?
Спасибо за любую помощь
- бытовая химия
$\endgroup$
4
$\begingroup$
Если горение происходит в кислороде, релевантны (как минимум) следующие реакции:
$$\ce{C + O2 -> CO2} $$
$$\ce{C + 1/2 O2 -> CO} $$
Вы можете улучшить первую реакцию, если в газовой фазе будет больше кислорода, так как она требует в два раза больше $\ce{O2}$, чем первая.
Тем не менее, одним из наиболее важных факторов является температура: высокая температура всегда благоприятствует продукту $\ce{CO}$, так как реакция должна протекать быстро и реагировать с любым доступным кислородом.
Эти зависимости хорошо видны на рисунке 6 этой статьи, при низких температурах отношение СО/СО2 низкое, но быстро увеличивается при нагревании.
Более подробную информацию легко найти в некоторых классических статьях, полной докторской диссертации или даже в расчетах с использованием современных методов квантовой химии.
$\endgroup$
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя адрес электронной почты и пароль
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания и подтверждаете, что прочитали и поняли нашу политику конфиденциальности и кодекс поведения.
Угарный газ и углекислый газ: сравним
В чем разница между угарным газом и двуокисью углерода? Если вы путаете их, вы не одиноки. Вы, наверное, знаете, что это два разных газа, но какой из них хороший, а какой плохой? Правильно ли вообще классифицировать их таким образом? Прежде чем перейти к тому, как и где окись углерода (CO) и двуокись углерода (CO2) влияют на людей и окружающую среду, а также о том, как их тестировать, давайте разберемся, откуда они берутся.
Оба газа представляют собой комбинацию углерода и кислорода, поэтому их названия похожи. Но эти газы создаются в результате различных химических реакций.
Откуда берется углекислый газ?
Углекислый газ является результатом полного сгорания. Полное сгорание – это химическая реакция, при которой углеводород взаимодействует с кислородом с образованием углекислого газа и воды. Полное сгорание часто (но не всегда) связано с пламенем. Вы наблюдаете полное сгорание, когда смотрите, как горит свеча: воск свечи — это углеводород, который вступает в реакцию с кислородом воздуха и теплом от зажженного фитиля. Углекислый газ выделяется в воздух в виде бесцветного газа без запаха. Это в основном нереактивный газ, и после выпуска он быстро смешивается с атмосферой.
Вы наблюдаете полное сгорание, когда смотрите, как горит свеча: воск свечи — это углеводород, который вступает в реакцию с кислородом воздуха и теплом от зажженного фитиля. Углекислый газ выделяется в воздух в виде бесцветного газа без запаха. Это в основном нереактивный газ, и после выпуска он быстро смешивается с атмосферой.
Двуокись углерода также производится в ходе промышленных процессов. Промышленные предприятия, производящие водород или аммиак из природного газа, угля или ферментации в больших объемах, являются одними из крупнейших коммерческих производителей двуокиси углерода. Углекислый газ имеет множество применений в пищевой промышленности и производстве напитков, включая газирование напитков.
Откуда берется окись углерода?
Угарный газ, с другой стороны, является результатом неполного сгорания. Неполное сгорание происходит при ограниченном доступе воздуха, поэтому к углероду присоединяется только половина кислорода, образуя монооксид углерода (CO = один атом кислорода, CO2 = два атома кислорода).
В отличие от двуокиси углерода, угарный газ не встречается в природе в атмосфере. Он образуется при неполном сгорании угля, природного газа и нефти. Низкий уровень кислорода и низкие температуры приводят к образованию угарного газа в горючей смеси.
Опасные уровни угарного газа могут образовываться в любом топливном приборе, включая газовые печи, газовые плиты, газовые сушилки, газовые водонагреватели, камины и автомобили. Поскольку это бесцветный газ без запаха, вы не можете идентифицировать его без детекторов газа.
В промышленных условиях двигатель внутреннего сгорания является основным источником угарного газа. Многие печи и печи производят большое количество газа, особенно если они не обслуживаются должным образом. Водители грузовиков, операторы вилочных погрузчиков или люди, работающие рядом с этим типом оборудования, подвергаются более высокому риску воздействия. Работники вблизи или в закрытых помещениях или замкнутых пространствах, таких как люки, гаражи, туннели, погрузочные доки, склады, мастерские по ремонту автомобилей и машины для сращивания, также подвергаются риску.
Хотя монооксид углерода обычно является нежелательным побочным продуктом, упакованный монооксид углерода используется в различных отраслях промышленности, включая производство металлов, химическое производство, фармацевтику, электронику и полупроводники, а также для восстановления руд при производстве карбонилов металлов.
Опасность для здоровья, связанная с угарным газом и двуокисью углерода
Хотя отравление двуокисью углерода встречается редко, его высокая концентрация в замкнутом пространстве может быть токсичной. Избыток углекислого газа занимает пространство в воздухе вместо кислорода, создавая среду для удушья. Симптомы легкого отравления углекислым газом включают головные боли и головокружение при концентрациях менее 30 000 частей на миллион. При концентрации 80 000 частей на миллион CO2 может быть опасным для жизни. Для справки, OSHA (Управление по безопасности и гигиене труда) установило допустимый предел воздействия CO2 (PEL) в 5000 частей на миллион в течение восьми часов и 30 000 частей на миллион в течение 10-минутного периода.
Угарный газ — гораздо более опасный газ. Угарный газ, также известный как «Бесшумный убийца», представляет собой бесцветный, не имеющий запаха, вкуса и не вызывающий раздражения газ, поэтому ранние признаки отравления трудно обнаружить. По оценкам Центров по контролю и профилактике заболеваний, более 50 000 человек в США госпитализированы с симптомами отравления угарным газом, а более 430 человек ежегодно умирают от этого газа. [3] Угарный газ настолько опасен, потому что он связывается с частями вашей крови, которые несут молекулы кислорода, поэтому он химически блокирует ваше тело и органы от получения необходимого им кислорода. Текущий допустимый предел воздействия OSHA (PEL) для окиси углерода составляет 50 частей на миллион в среднем за восемь часов, что намного ниже, чем PEL для двуокиси углерода. Уровень воздействия, который считается непосредственно опасным для жизни и здоровья (IDLH), составляет 1500 частей на миллион.
Использование детекторов газа для измерения угарного газа и двуокиси углерода
Когда дело доходит до выбора промышленного детектора газа для рабочего места, детектор угарного газа с одним газом не измеряет уровни углекислого газа и не работает в обратном направлении.
