УГАРНЫЙ ГАЗ | Энциклопедия Кругосвет
ОКСИД УГЛЕРОДА (УГАРНЫЙ ГАЗ). Углерода(II) оксид (угарный газ) СО, несолеообразующий оксид углерода. Это означает, что не существует кислоты, соответствующей этому оксиду. Оксид углерода(II) – газ без цвета и запаха, сжижающийся при атмосферном давлении при температуре –191,5о С и затвердевающий при –205о С. Молекула СО по своему строению аналогична молекуле N2: обе содержит равное число электронов (такие молекулы называются изоэлектронными), атомы в них соединены тройной связью (две связи в молекуле СО образованы за счет 2р-электронов атомов углерода и кислорода, а третья – по донорно-акцепторному механизму с участием неподеленной электронной пары кислорода и свободной 2р-орбитали углерода). В результате физические свойства СО и N2 (температуры плавления и кипения, растворимость в воде и т.д.) очень близки.
Оксид углерода(II) образуется при сгорании углеродсодержащих соединений при недостаточном доступе кислорода, а также при соприкосновении раскаленного угля с продуктом полного сгорания – углекислым газом: С + СО2 → 2СО. В лаборатории СО получают дегидратацией муравьиной кислоты действием концентрированной серной кислоты на жидкую муравьиную кислоту при нагревании, либо пропусканием паров муравьиной кислоты над Р2О5: НСООН → СО + Н2О. Получают СО и разложением щавелевой кислоты: Н2С2О4 → СО + СО2 + Н2О. От других газов СО легко отделить пропусканием через раствор щелочи.
В лаборатории СО получают дегидратацией муравьиной кислоты действием концентрированной серной кислоты на жидкую муравьиную кислоту при нагревании, либо пропусканием паров муравьиной кислоты над Р2О5: НСООН → СО + Н2О. Получают СО и разложением щавелевой кислоты: Н2С2О4 → СО + СО2 + Н2О. От других газов СО легко отделить пропусканием через раствор щелочи.
При обычных условиях СО, как и азот, химически довольно инертен. Лишь при повышенных температурах проявляется склонность СО к реакциям окисления, присоединения и восстановления. Так, при повышенных температурах он реагирует со щелочами: CO + NaOH → HCOONa, CO + Ca(OH)2 → CaCO3 + h3. Эти реакции используются для удаления СО из технических газов.
Оксид углерода(II) – высококалорийное топливо: горение сопровождается выделением значительного количества теплоты (283 кДж на 1 моль СО). Смеси СО с воздухом взрываются при его содержании от 12 до 74%; к счастью, на практике такие смеси встречаются исключительно редко. В промышленности для получения СО проводят газификацию твердого топлива.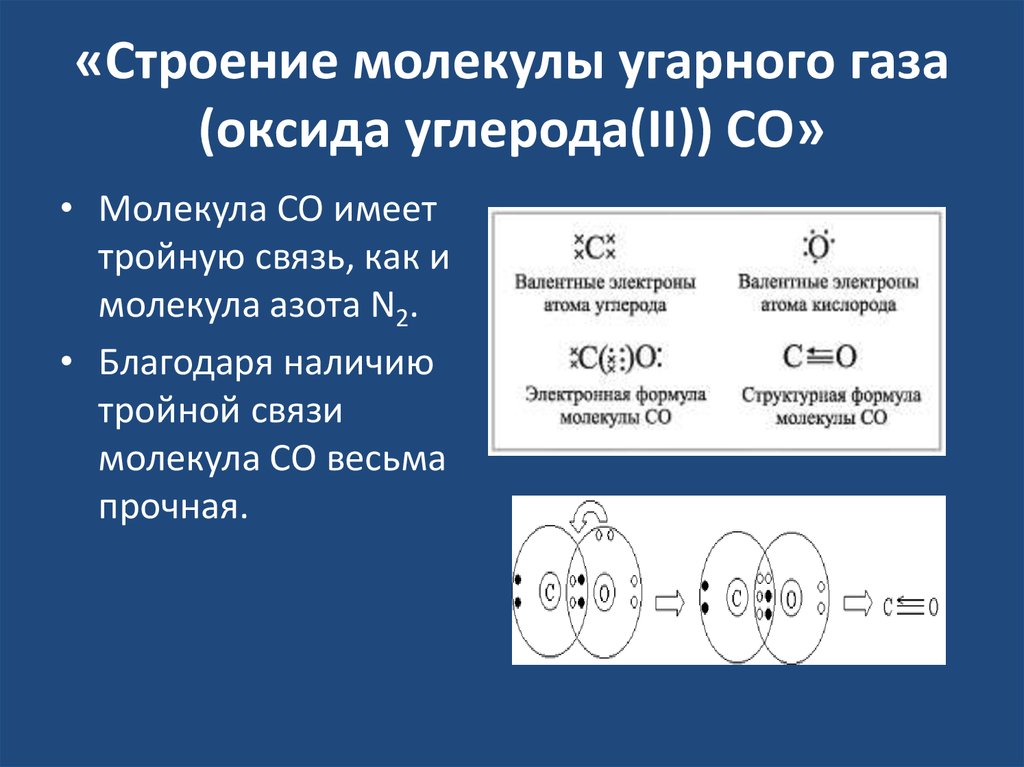 Например, продувание водяного пара через слой раскаленного до 1000o С угля приводит к образованию водяного газа: С + Н2О → СО + Н2, обладающего очень высокой теплотворной способностью. Однако сжигание – далеко не самое выгодное использование водяного газа. Из него, например, можно получить (в присутствии различных катализаторов под давлением) смесь твердых, жидких и газообразных углеводородов – ценное сырье для химической промышленности (Реакция Фишера – Тропша). Из той же смеси, обогатив ее водородом и применив нужные катализаторы, можно получить спирты, альдегиды, кислоты. Особое значение имеет синтез метанола: СО + 2Н2 → СН3ОН – важнейшего сырья для органического синтеза, поэтому эту реакцию проводят в промышленности в больших масштабах.
Например, продувание водяного пара через слой раскаленного до 1000o С угля приводит к образованию водяного газа: С + Н2О → СО + Н2, обладающего очень высокой теплотворной способностью. Однако сжигание – далеко не самое выгодное использование водяного газа. Из него, например, можно получить (в присутствии различных катализаторов под давлением) смесь твердых, жидких и газообразных углеводородов – ценное сырье для химической промышленности (Реакция Фишера – Тропша). Из той же смеси, обогатив ее водородом и применив нужные катализаторы, можно получить спирты, альдегиды, кислоты. Особое значение имеет синтез метанола: СО + 2Н2 → СН3ОН – важнейшего сырья для органического синтеза, поэтому эту реакцию проводят в промышленности в больших масштабах.
Реакции, в которых СО является восстановителем, можно продемонстрировать на примере восстановления железа из руды в ходе доменного процесса: Fe3O4 + 4CO → 3Fe + 4CO2. Восстановление оксидов металлов оксидом углерода(II) имеет большое значение в металлургических процессах.
Для молекул СО характерны реакции присоединения к переходным металлам и их соединениям с образованием комплексных соединений – карбонилов. Примерами могут служить жидкие или твердые карбонилы металлов Fe(CO)4, Fe(CO)5, Fe2(CO)9, Ni(CO)4, Cr(CO)6 и др. Это очень ядовитые вещества, при нагревании вновь распадающиеся на металл и СО. Так можно получить порошкообразные металлы высокой чистоты. Иногда на конфорке газовой плиты видны «подтеки» металла, это – следствие образования и распада карбонила железа. В настоящее время синтезированы тысячи разнообразных карбонилов металлов, содержащих, помимо СО, неорганические и органические лиганды, например, PtCl2(CO), K3[W(CO)6(OH)3], Cr(C6H5Cl)(CO)3.
Для СО характерна также реакция соединения с хлором, которая на свету идет уже при комнатной температуре с образованием исключительно ядовитого фосгена: CO + Cl2 → COCl2. Реакция эта цепная, она идет по радикальному механизму с участием атомов хлора и свободных радикалов COCl. Несмотря на ядовитость, фосген широко применяется для синтеза многих органических соединений.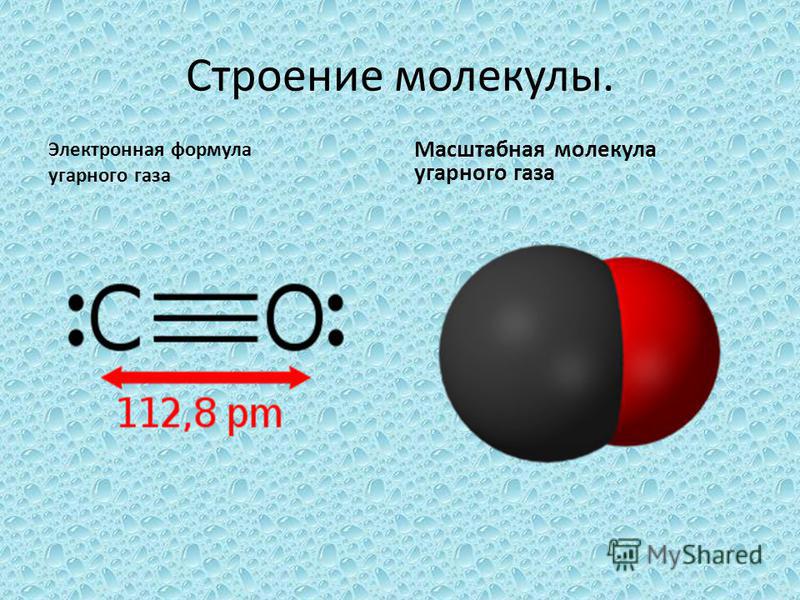
Оксид углерода(II) – сильный яд, так как образует с металлсодержащими биологически активными молекулами прочные комплексы; при этом нарушается тканевое дыхание. Особенно страдают клетки центральной нервной системы. Связывание СО с атомами Fe(II) в гемоглобине крови препятствует образованию оксигемоглоблина, который и переносит кислород из легких к тканям. Уже при содержании в воздухе 0,1% СО этот газ вытесняет из оксигемоглобина половину кислорода. В присутствии СО может наступить смерть от удушья даже при наличии большого количества кислорода. Поэтому СО получил название угарного газа. У «угоревшего» человека в первую очередь страдают головной мозг и нервная система. Для спасения необходим прежде всего чистый воздух, не содержащий СО (а еще лучше – чистый кислород), при этом связанный с гемоглобином СО постепенно замещается молекулами О2 и удушье проходит. Предельно допустимая среднесуточная концентрация СО в атмосферном воздухе составляет 3 мг/м3 (около 3.10–5%), в воздухе рабочей зоны – 20 мг/м3.
Обычно в атмосфере содержание СО не превышает 10–5%. Этот газ попадает в воздух в составе вулканических и болотных газов, с выделениями планктона и других микроорганизмов. Так, из поверхностных слоев океана в атмосферу ежегодно выделяется 220 млн тонн СО. Высока концентрация СО в угольных шахтах. Много угарного газа образуется при лесных пожарах. Выплавка каждого миллиона тонн стали сопровождается образованием 300 – 400 т СО. В сумме техногенное выделение СО в воздух достигает 600 млн тонн в год, из них более половины приходится на автотранспорт. При неотрегулированном карбюраторе в выхлопных газах может содержаться до 12% СО! Поэтому в большинстве стран введены жесткие нормы на содержание СО в выхлопе автомобилей.
Образование СО всегда происходит при сгорании углеродсодержащих соединений, в том числе древесины, при недостаточном доступе кислорода, а также при соприкосновении раскаленного угля с углекислым газом: С + СО2 → 2СО. Такие процессы происходят и деревенских печах.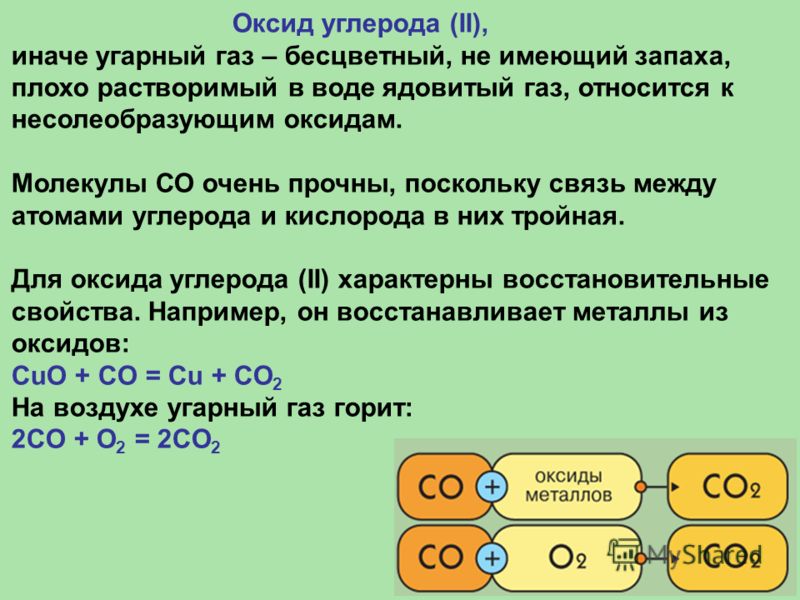 Поэтому преждевременное закрывание дымохода печи для сохранения тепла часто приводит к отравлению угарным газом. Не следует думать что горожане, которые не топят печи, застрахованы от отравления СО; им, например, легко отравиться в плохо проветриваемом гараже, где стоит автомобиль с работающим мотором. Содержится СО и в продуктах сгорания природного газа на кухне. Многие авиационные катастрофы в прошлом произошли из-за износа двигателей или плохой их регулировки: в кабину пилотов проникал СО и отравлял экипаж. Опасность усугубляется тем, что СО невозможно обнаружить по запаху; в этом отношении угарный газ опаснее хлора!
Поэтому преждевременное закрывание дымохода печи для сохранения тепла часто приводит к отравлению угарным газом. Не следует думать что горожане, которые не топят печи, застрахованы от отравления СО; им, например, легко отравиться в плохо проветриваемом гараже, где стоит автомобиль с работающим мотором. Содержится СО и в продуктах сгорания природного газа на кухне. Многие авиационные катастрофы в прошлом произошли из-за износа двигателей или плохой их регулировки: в кабину пилотов проникал СО и отравлял экипаж. Опасность усугубляется тем, что СО невозможно обнаружить по запаху; в этом отношении угарный газ опаснее хлора!
Оксид углерода(II) практически не сорбируется активным углем и потому обычный противогаз не спасает от этого газа; для его поглощения необходим дополнительный гопкалитовый патрон, содержащий катализатор, который «дожигает» СО до СО2 с помощью кислорода воздуха. Катализаторами дожигания снабжается сейчас все больше легковых автомобилей, несмотря на высокую стоимость этих катализаторов на основе платиновых металлов.
Илья Леенсон
Проверь себя!
Ответь на вопросы викторины «Неизвестные подробности»
Какой музыкальный инструмент не может звучать в закрытом помещении?
Пройти тест
Угарный газ помог ученым увидеть связи между атомами углерода
https://ria.ru/20120913/749573236.html
Угарный газ помог ученым увидеть связи между атомами углерода
Угарный газ помог ученым увидеть связи между атомами углерода — РИА Новости, 13.09.2012
Угарный газ помог ученым увидеть связи между атомами углерода
Молекула угарного газа, присоединенная к жалу атомно-силового микроскопа, позволила физикам рассмотреть отдельные химические связи между атомами углерода в «шарике» фуллерена и некоторых органических веществах, говорится в статье, опубликованной в журнале Science.
2012-09-13T22:07
2012-09-13T22:07
2012-09-13T22:07
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21. img.ria.ru/images/sharing/article/749573236.jpg?7495716991347559647
img.ria.ru/images/sharing/article/749573236.jpg?7495716991347559647
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2012
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
1
5
4. 7
7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
МОСКВА, 13 сен — РИА Новости. Молекула угарного газа, присоединенная к жалу атомно-силового микроскопа, позволила физикам рассмотреть отдельные химические связи между атомами углерода в «шарике» фуллерена и некоторых органических веществах, говорится в статье, опубликованной в журнале Science.
Атомно-силовой микроскоп относится к числу наиболее чувствительных измерительных приборов, позволяющих изучать структуру материалов с практически атомной точностью. Сердцем такого микроскопа является сверхтонкая игла из металла и присоединенная к ней упругая пластинка, которая вибрирует при движении щупа по образцу материала. Эти колебания преобразуются в картинку при помощи лазера, отражения луча которого меняется в зависимости от силы вибраций.
Группа физиков под руководством Лео Гросса (Leo Gross) из исследовательского центра компании IBM в Цюрихе (Швейцария) приспособила атомно-силовой микроскоп для изучения отдельных химических связей, присоединив к медной игле устройства молекулу углекислого газа.
Авторы статьи воспользовались тем, что каждый тип химической связи характеризуется определенным расстоянием между связанными атомами и особой пространственной конфигурацией валентных электронов. Когда наконечник микроскопа приближается к молекуле, на него начнет действовать сила, порожденная взаимным отталкиванием электронных облаков в атомах образца и кончика иглы. Если жало будет достаточно тонким и чувствительным, то частота колебаний наконечника будет меняться при перемещении от одной химической связи к другой.
Гросс и его коллеги перебрали несколько вариантов наконечника и в конечном итоге остановились на молекуле углекислого газа, присоединенной к медной игле микроскопа. По их словам, угарный газ достаточно чувствителен к искажениям, которые возникают в результате взаимного отталкивания, и при этом не взаимодействует с изучаемой молекулой на химическом уровне.
Физики проверили работу своего изобретения, изучив структуру химических связей в молекуле фуллерена — шарике из 60 соединенных друг с другом атомов углерода. По их словам, микроскоп успешно справился с этой задачей — на картинке ученые увидели характерную мозаику из двойных и одиночных связей, характерных для фуллеренов.
По их словам, микроскоп успешно справился с этой задачей — на картинке ученые увидели характерную мозаику из двойных и одиночных связей, характерных для фуллеренов.
Убедившись в работоспособности прибора, Гросс и его коллеги рассмотрели «рисунок» связей в молекулах нескольких ароматических углеводородов. По их словам, микроскоп позволяет не только отличать одиночные, двойные и тройные связи, но и измерять их длину с точностью до 0,03 ангстрема, или 3 пикометра (10 в минус 12-й степени метра).
Физики полагают, что их методика может найти применение при изучении работы катализаторов, ферментов и при наблюдениях за сложными химическими реакциями.
Учебное пособие по связям с окисью углерода
Инструменты Creator скоро будут вдохновлять!
Присоединяйтесь к списку рассылки, чтобы узнать, когда мы запустимся.
Химия
Общая химия
Ковалентная связь
Учебное пособие по связям монооксида углерода атом кислорода.
Содержание
ВВЕДЕНИЕ
Вдыхание дыма является одной из наиболее распространенных и серьезных проблем, с которыми сталкиваются пожарные. Если не лечить, это может быть фатальным и опасным для жизни. Но почему это так плохо? Это происходит из-за газов, таких как окись углерода и двуокись углерода в дыме. Эти газы попадают в кровоток при вдыхании и могут вызвать катастрофические повреждения головного мозга и других органов. Угарный газ является самым смертоносным среди всех газов из-за его высокого сродства к соединению с гемоглобином.
Источник
УГАРНЫЙ МОНОКСИД:
Угарный газ является самым основным оксоуглеродом или оксидом углерода. Угарный газ (СО) — бесцветный газ без запаха, немного легче воздуха. Несмотря на то, что он создается в процессе обмена веществ и обладает определенной биологической активностью, в больших дозах он ядовит для людей и животных.
Источник
СВЯЗЬ УГЛЕКИСЛОГО УГЛЕРОДА:
Один атом углерода и один атом кислорода соединены тройной связью в монооксиде углерода. Атомы углерода и кислорода разделены на 112,8 мкм, что указывает на наличие тройной связи.
Атомы углерода и кислорода разделены на 112,8 мкм, что указывает на наличие тройной связи.
CO имеет самую сильную из наблюдаемых химических связей с энергией диссоциации связи 1072 кДж/моль. CO имеет три резонансные конфигурации. Однако структура тройной связи наиболее близка к истинному распределению электронной плотности в соединении.
РЕЗОНАНСНАЯ СТРУКТУРА:
Три различные резонансные структуры стабилизируют монооксид углерода. Существенное резонансное устройство является первым.
Источник
БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ:
CO представляет собой сигнальную молекулу, естественным образом вырабатываемую человеческим организмом. Ряд заболеваний, особенно гипертония и сердечная недостаточность, связаны с аномалиями его метаболизма.
CO преобладает в незначительных концентрациях в атмосфере, в основном из-за сжигания ископаемого топлива и пожаров. В конечном итоге он превращается в углекислый газ в атмосфере естественными механизмами.
ЗАКЛЮЧЕНИЕ
- Один атом углерода и один атом кислорода составляют молекулу монооксида углерода.

- CO имеет три конфигурации резонанса; однако структура тройной связи наиболее близка к истинному распределению электронной плотности в соединении.
- CO преобладает в незначительных концентрациях в атмосфере, главным образом в результате сжигания ископаемого топлива и пожаров.
Часто задаваемые вопросы:
1. Какая связь у CO?
В монооксиде углерода углерод и кислород сначала образуют двойную ковалентную связь. Сначала кислород и углерод делят по два своих валентных электрона. Получается двойная ковалентная связь. При этом кислород становится стабильным. Но углерод все еще не стабилизирован. Следовательно, кислород теперь делит одну из своих неподеленных пар с углеродом, что приводит к координированной ковалентной или дательной связи. После образования дательная связь действует так же, как обычная ковалентная связь. Следовательно, окись углерода имеет тройную ковалентную связь.
2. Что означает связь CO?
Окись углерода имеет тройную ковалентную связь, в которой две нормальные ковалентные связи и одна дательная связь. Сама дательная связь является координационной ковалентной связью. Здесь кислород делит свою неподеленную пару электронов с углеродом, образуя координационную ковалентную связь. После образования эта связь действует как обычная ковалентная связь.
Сама дательная связь является координационной ковалентной связью. Здесь кислород делит свою неподеленную пару электронов с углеродом, образуя координационную ковалентную связь. После образования эта связь действует как обычная ковалентная связь.
3. Сколько связей в СО?
Угарный газ имеет тройную ковалентную связь. Две обычные ковалентные связи и одна координационная связь.
Мы надеемся, что вам понравился этот урок, и вы узнали что-то интересное о Связка угарного газа ! Присоединяйтесь к нашему сообществу Discord, чтобы получить ответы на любые вопросы и пообщаться с другими студентами, такими же, как и вы! Не забудьте загрузить наше приложение, чтобы испытать наши веселые классы виртуальной реальности — мы обещаем, это делает учебу намного веселее! 😎
ИСТОЧНИКИ:
- Координата Ковалентная связь. https://www.ck12.org/c/chemistry/coordinate-covalent-bond/lesson/Coordinate-Covalent-Bonds-CHEM/?referrer=concept_details.
 По состоянию на 23 января 2022 г.
По состоянию на 23 января 2022 г. - Свойства угарного газа. https://www.vedantu.com/question-answer/угарный газ-has-a-bond-between-c-and-o-a-class-12-chemistry-cbse-5f625c5d01faef2daa4dfc56. По состоянию на 23 января 2022 г.
Угарный газ имеет ………. связь между C и O.(A) Triple(B) Double (C) Single(D) Ionic
Дата последнего обновления: 08 апреля 2023
•
Всего просмотров: 282.3k
•
Просмотров сегодня: 6.55 k
Ответ
Проверено
282,3 тыс.+ просмотров
Подсказка: В молекулах угарного газа присутствуют две ковалентные связи и одна координационная связь. Порядок связи угарного газа равен трем. Итак, связь между С и О достаточно прочная.
Полный пошаговый ответ:
В CO существует тройная связь между C и O.
Из этих трех связей две образуются за счет совместного использования электронов (ковалентная связь) между C и O. И одна связь представляет собой координационную связь, в которой кислород отдает свою неподеленную пару электронов атому углерода. 9{ 0 }$ между атомами C и O.
И одна связь представляет собой координационную связь, в которой кислород отдает свою неподеленную пару электронов атому углерода. 9{ 0 }$ между атомами C и O.
Как мы знаем, одна из связей в СО является координационной связью, которая образуется за счет передачи неподеленных пар электронов от кислорода к атомам углерода.
Мы должны знать еще одну вещь: поскольку электроны передаются от атома кислорода к атому углерода, следовательно, в реальной структуре монооксида углерода существует частичный положительный заряд на атоме кислорода и частичный отрицательный заряд на атоме углерода, как показано на рисунке. ниже:
Из этого мы можем узнать, что между C и O в молекулах CO существует тройная связь.
Следовательно, вариант (А) тройная связь является правильным ответом.
Дополнительная информация: Монооксид углерода также является хорошо известным ${ \pi }$ -кислотным лигандом / ${ \pi }$ акцепторным лигандом.
Кислотный лиганд ${ \pi }$ представляет собой лиганд, который может образовывать дополнительную двойную связь, принимая неподеленную пару электронов от металла, наряду с нормальными связями ${ \sigma }$ .


 По состоянию на 23 января 2022 г.
По состоянию на 23 января 2022 г.