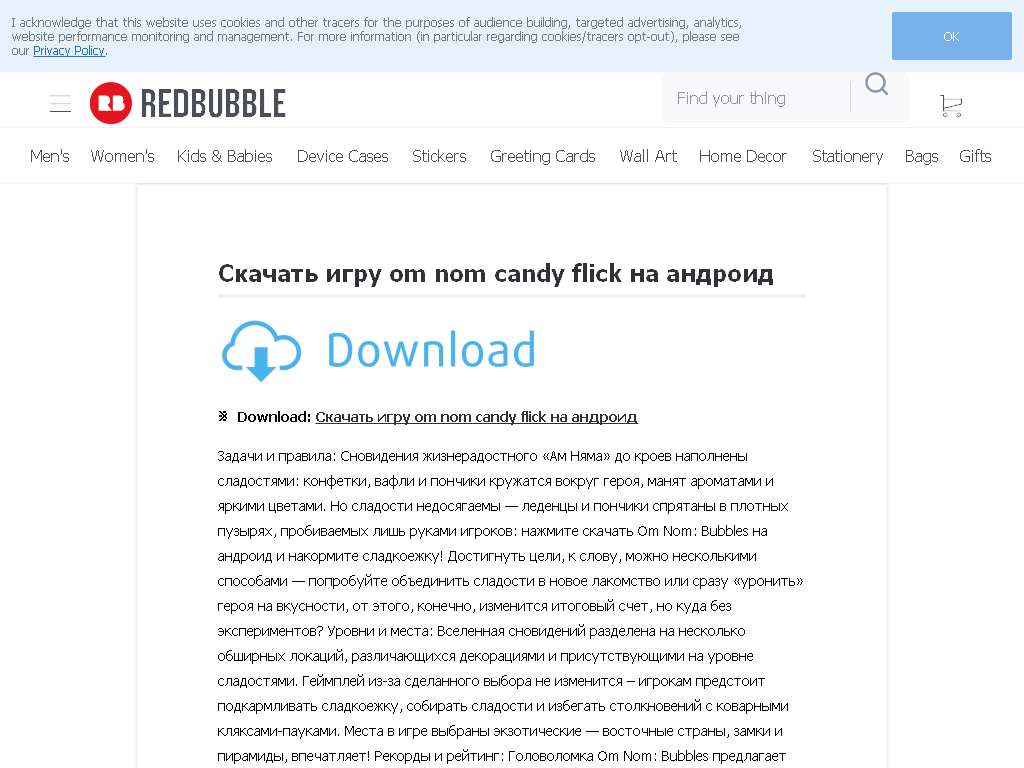
кладка печей — КЛАДКА ПЕЧЕЙ
Привет брат строитель! Догадываюсь сколько времени у тебя ушло на поиск кладки печей прежде чем ты открыл эту страницу. У меня нет планов убить твое время на монотонные выдержки из википедии и книжек 40 годов прошлого века, кормить вас непровереной информацией скопированой у таких же всезнаек. Я обьединил в один раздел все самое необходимое для опытного и начинающего печника: в первую очередь это 40 схем кирпичных печей, десятки чертежей керамических каминов, 10 порядовок кухонных плит, основные моменты для приготовления глинянного раствора и выбора качественного недорогова кирпича. Расмотрим цены на кладку каминов и печей в разных регионах на 2013 год Для начинающих подробно опишу основные элементы теоретической подготовки. В общей сложности раздел содержит ссылки на 34 лучших статей нашего портала, не 1 грамма воды только ровные швы и сильная тяга.
osnovaremonta.ru
Порядовая кладка кирпичных печей
Если вы надумаете зарабатвывать деньги своими руками кладкой печей первое с чем вы столкнетесь это 2 секрета каменщиков. Первый секрет даже опытные печники со стажем работы в 10-20 лет пользуються старыми проверенными временем порядовками и постояно ищут новые им неизвестные, второй секрет опытные печники не когда не дадут вам лучшие свои чертежи, в лучшем случае дадут стандартные порядовки Шведок Голандок или простых отопительных. Поскольку я побольшей части занимаюсь только кладкой каминов и продажей печной фурнитуры, конкуренции в вас я не вижу и все известные мне схемы публикую на сайте. Итак начнем от простого к сложному «кухонные кирпичные плиты» и отопительные щитки:
Первый секрет даже опытные печники со стажем работы в 10-20 лет пользуються старыми проверенными временем порядовками и постояно ищут новые им неизвестные, второй секрет опытные печники не когда не дадут вам лучшие свои чертежи, в лучшем случае дадут стандартные порядовки Шведок Голандок или простых отопительных. Поскольку я побольшей части занимаюсь только кладкой каминов и продажей печной фурнитуры, конкуренции в вас я не вижу и все известные мне схемы публикую на сайте. Итак начнем от простого к сложному «кухонные кирпичные плиты» и отопительные щитки:
- Кухонная плита с духовкой
- Кухонная плита с духовкой и водогрейным котлом
- Кухонная кирпичная печь для квартир
- Простая кирпичная кухонная плита
- Кухонная кирпичная плита на шанцах
- Кухонная кирпичная плита с котлом (КПВ-2)
- Трехканальный кирпичный отопительный щиток для кухонной плиты.

- Кирпичный топительный щиток нижнего прогрева. (теплоемкость-7,1кВт)
osnovaremonta.ru
Порядовки отопительно-варочных печей
Трехканальные шведки, колпаковые ОТП с нижним обогревом, голандки из облицовочного кирпича «lode», дачные многофункциональные печи и массивные Русские печи с 8 кВт теплоемкости-все это наши рабочие лошадки отопительно-варочные печи , 80% заказов в частном секторе принадлежат им. Выбирайте печь не только красивой и маленькой, уделяйте большое внимание функциональности и теплоемкости печи.
- Круглая печь в метал футляре
- Малая от-вар печь с духовкой
- Отопительно-варочные печи
- Малая отоп-варочн печь
- Печь Буслаева
- Печь дачная
- Печь Т-образной формы
- Печь экономка
- Прямоуг.
 бесканальная печь
бесканальная печь - Прямоугольная отопительная печь
- Отопительно-варочная печь конструкции И.Ф. ВолковаПечь Грум-Грижимайло
- Прямоугольная печь
- Русская печь
- кладка печи «шведка» буслаева (порядовка кладки)
- Печь голландка (схема+описание).
- Печь Проскурина( обучающее видео » кладка печей » )
- Прямоугольная отопительная печь с тремя вертикальными каналами
- Необычная трехугольная печь
- Кирпичная банная печь с открытой каменкой и котлом для воды.
- Простая кирпичная печь для большой бани
- Печь отопительная с нижним прогревом(3х2,5 кирпича)
- Отопительно-варочная печь нижнего прогрева 7,5кВт мощности(5х4,5 кирпича)
- Кирпичная печь для отопления гаража 7,2кВт.
 (2,5х8,5 кирпича)
(2,5х8,5 кирпича) - Банная печь каменка Порфирьева (4х5 кирпичей)-для бани площадью 12 метров.
osnovaremonta.ru
Видеоуроки ( кладка каминов )Внимание!!! если в процесе прочтения статьи кладка печей у
вас возникли вопросы обязательно отметьте ето ниже в комментариях.Отдельное спасибо
тем кто поставил «гугл+1» для нас это большой «+».
Поиск по сайту
Search for:
Реклама от google
Официальный Интернет-портал администрации муниципального образования город Краснодар и городской Думы Краснодара :: Krd.ru
Официальный Интернет-портал администрации муниципального образования город Краснодар и городской Думы Краснодара :: Krd.ru
English
Версия для слабовидящих
Связь с администрацией
Личный кабинет
krd. ru
ru
Администрация и городская Дума Краснодара
Закрыть
Поиск по сайту
Введите запрос для поиска например, структура администрации
Главные новости
Все новости
В Пасхальную ночь в 55 храмах Краснодара прошли божественные литургии
16 апреля 2023,
07:24
В Краснодаре завершился Всероссийский патриотический форум активистов движения «Пост №1»
15 апреля 2023,
21:16
В районе ул. Московской строят 200 метров трамвайных путей
15 апреля 2023,
16:58
Пасхальные богослужения в храмах Краснодара покажут в прямом эфире
15 апреля 2023,
16:15
В Музыкальном микрорайоне завершается строительство детского сада на 280 мест
15 апреля 2023,
15:32
Подписаться на рассылку новостей
Новости городской Думы
Тепла и добра вам, ребята!
15 апреля 2023,
14:03
Низкий поклон вам, ребята!
15 апреля 2023,
10:08
Сбалансированный бюджет и финансовая стабильность — необходимое условие поступательного развития города
14 апреля 2023,
17:00
Заседания комитетов в преддверии 56 очередного заседания Думы завершены
13 апреля 2023,
16:25
Все новости
Новости внутригородских округов
Карасунский округ
Членов президиума Совета директоров и Координационного Совета общественных организаций поздравили с юбилеем Карасунского округа
14 апреля 2023,
16:28
Центральный округ
В Центральном округе прошел субботник на четырех улицах округа
14 апреля 2023,
14:57
Западный округ
С Днем Рождения поздравили вдову Героя России Надежду Сарабееву
14 апреля 2023,
13:51
Прикубанский округ
Легализация трудовых отношений – Основа защиты прав работника!
14 апреля 2023,
13:19
Популярное на сайте
Строительство и проектирование социальных объектов Краснодара
Оформление земельно-правовой документации под гаражом («гаражная амнистия»)
Бесплатная газификация
Официальное опубликование
Структура администрации
Вакансии в администрации
Интернет — приемная
Публичные слушания
Аукционы, конкурсы, торги
Противодействие коррупции
Общественные обсуждения
Услуги горожанам
Все услуги
Разрешение на установку рекламных конструкций
Запись в детский сад
Разрешение на строительство
Согласование переустройства и перепланировки
Смена категории жилья
Учет нуждающихся в жилье
Это важно
Форум «Сильные идеи для нового времени»
12 апреля 2023
10:55
Весь список
Краснодарцам предлагают ознакомиться с памяткой для владельцев домашних животных
4 апреля 2023
11:55
Голосование по выбору зелёных зон
для благоустройства в 2024 году
Контрактная служба
Достоверно и наглядно
о том что важно прямо сейчас
Ярмарки выходного дня
Горячие линии
Берегите себя и своих Близких
#НаденьМаску
Опрос населения об эффективности деятельности руководителей органов местного самоуправления
Коронавирус COVID–19
Официальная информация
Другое дело
Учись, развивайся, помогай — получай бонусы
Региональные проекты Краснодарский край
Реализация указа Президента РФ «О национальных целях и стратегических задачах развития РФ на период до 2024 года»
Прочистка сетей ливневой канализации
Сделано на Кубани!
Краевой конкурс в области качества
Оценка регулирующего воздействия проектов нормативных правовых актов
Строительство и проектирование школ и детских садов в Краснодаре
#гдемусор
Подписка на рассылку
Введите E-mail на который хотите получать рассылку*:
Ошибка: заполните поле
Сообщить об ошибке
Рибонуклеотиды в ДНК: происхождение, репарация и последствия
1. Крик Ф. Центральная догма молекулярной биологии. Природа. 1970; 227: 561–563. [PubMed] [Google Scholar]
Крик Ф. Центральная догма молекулярной биологии. Природа. 1970; 227: 561–563. [PubMed] [Google Scholar]
2. Cech TR. Миры РНК в контексте. Колд Спринг Харбор Перспект Биол. 2012;4:a006742. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Li Y, Breaker RR. Кинетика деградации РНК с помощью специфического основного катализа переэтерификации с участием 2′-гидроксильной группы. J Am Chem Soc. 1999; 121:5326–5372. [Академия Google]
4. Эгли М., Усман Н., Рич А. Конформационное влияние 2′-гидроксильной группы рибозы: кристаллические структуры химерных дуплексов ДНК-РНК. Биохимия. 1993; 32:3221–3237. [PubMed] [Google Scholar]
5. Jaishree TN, van der Marel GA, van Boom JH, Wang AH. Структурное влияние включения РНК в ДНК: количественное уточнение ядерно-магнитным резонансом d(CG)r(CG)d(CG) и d(CG)r(C)d(TAGCG) Биохимия. 1993; 32:4903–4911. [PubMed] [Google Scholar]
6. Ban C, Ramakrishnan B, Sundaralingam M. Одна 2′-гидроксильная группа превращает B-ДНК в A-ДНК — кристаллическая структура ДНК-РНК химерного декамерного дуплекса d (CCGGC) R (CCGG) с новым межмолекулярным парным квадруплетом G-центр-точка-C. Дж Мол Биол. 1994;236:275–285. [PubMed] [Google Scholar]
Дж Мол Биол. 1994;236:275–285. [PubMed] [Google Scholar]
7. DeRose EF, Perera L, Murray MS, Kunkel TA, London RE. Структура раствора додекамера ДНК Дикерсона, содержащего один рибонуклеотид. Биохимия. 2012;51:2407–2416. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Bessman MJ, Kornberg A, Lehman IR, Simms ES. Ферментативный синтез дезоксирибонуклеиновой кислоты. Биохим Биофиз Акта. 1956; 21: 197–198. [PubMed] [Google Scholar]
9. Кухта Р.Д., Стенгель Г. Механизм и эволюция ДНК-примаз. Биохим Биофиз Акта. 2010; 1804:1180–1189. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Burgers PM. Динамика полимеразы на вилке репликации эукариотической ДНК. Дж. Биол. Хим. 2009; 284:4041–4045. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Zheng L, Shen B. Созревание фрагментов Оказаки: нуклеазы занимают центральное место. J Mol Cell Biol. 2011;3:23–30. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Балакришнан Л., Бамбара Р. А. Метаболизм фрагментов Окадзаки. Колд Спринг Харбор Перспект Биол. 2013;5:a010173. [Бесплатная статья PMC] [PubMed] [Google Scholar]
А. Метаболизм фрагментов Окадзаки. Колд Спринг Харбор Перспект Биол. 2013;5:a010173. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Йилес Дж. Т., Поли Дж., Марианс К. Дж., Пасеро П. Спасение заглохших или поврежденных вилок репликации. Колд Спринг Харбор Перспект Биол. 2013;5:a012815. [Статья бесплатно PMC] [PubMed] [Google Scholar]
14. Pomerantz RT, O’Donnell M. Реплисома использует мРНК в качестве праймера после столкновения с РНК-полимеразой. Природа. 2008; 456: 762–766. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Wan L, Lou J, Xia Y, Su B, Liu T, Cui J, Sun Y, Lou H, Huang J. hPrimpol1/CCDC111 представляет собой человеческую ДНК. праймаза-полимераза, необходимая для поддержания целостности генома. EMBO Rep. 2013; 14:1104–1112. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Garcia-Gomez S, Reyes A, Martinez-Jimenez MI, Chocron ES, Mouron S, Terrados G, Powell C, Salido E, Mendez J, Holt IJ, Blanco L. PrimPol, архаичная праймаза/полимераза, действующая в клетки человека. Мол Ячейка. 2013; 52: 541–553. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Мол Ячейка. 2013; 52: 541–553. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Бьянки Дж., Радд С.Г., Йозвяковски С.К., Бейли Л.Дж., Сура В., Тейлор Э., Стеванович И., Грин А.Дж., Стрэкер Т.Х., Линдсей Х.Д., Доэрти А.Дж. PrimPol обходит фотопродукты УФ-излучения во время репликации эукариотической хромосомной ДНК. Мол Ячейка. 2013; 52: 566–573. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Мурон С., Родригес-Асебес С., Мартинес-Хименес М.И., Гарсия-Гомес С., Чокрон С., Бланко Л., Мендес Дж. Повторное праймирование синтеза ДНК при остановленных вилках репликации с помощью PrimPol человека. Nat Struct Mol Biol. 2013;20:1383–1389. [PubMed] [Google Scholar]
19. Гао Г., Орлова М., Георгиадис М.М., Хендриксон В.А., Гофф С.П. Придание активности РНК-полимеразы ДНК-полимеразе: один остаток в обратной транскриптазе контролирует выбор субстрата. Proc Nat Acad Sci USA. 1997; 94: 407–411. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Джойс КМ. Выбор правильного сахара: как полимеразы выбирают нуклеотидный субстрат. Proc Nat Acad Sci USA. 1997; 94: 1619–1622. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Выбор правильного сахара: как полимеразы выбирают нуклеотидный субстрат. Proc Nat Acad Sci USA. 1997; 94: 1619–1622. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Shinkai A, Patel PH, Loeb LA. Консервативный мотив А активного центра ДНК-полимеразы I Escherichia coli сильно мутабелен. Дж. Биол. Хим. 2001; 276:18836–18842. [PubMed] [Google Scholar]
22. Госави Р.А., Мун А.Ф., Кункель Т.А., Педерсен Л.С., Бебенек К. Каталитический цикл включения рибонуклеотидов в ДНК человека Pol lambda. Нуклеиновые Кислоты Res. 2012;40:7518–7527. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Браун Дж. А., Суо З. Открытие сахарных «стерических ворот» ДНК-полимераз. Биохимия. 2011;50:1135–1142. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Кавано Н.А., Бирд В.А., Батра В.К., Перера Л., Педерсен Л.Г., Уилсон С.Х. Молекулярное понимание сдерживающих факторов ДНК-полимеразы для вставки рибонуклеотидов. Дж. Биол. Хим. 2011; 286:31650–31660. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Kasiviswanathan R, Copeland WC. Дискриминация рибонуклеотидов и обратная транскрипция митохондриальной ДНК-полимеразой человека. Дж. Биол. Хим. 2011;286:31490–31500. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Kasiviswanathan R, Copeland WC. Дискриминация рибонуклеотидов и обратная транскрипция митохондриальной ДНК-полимеразой человека. Дж. Биол. Хим. 2011;286:31490–31500. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Wang W, Wu EY, Hellinga HW, Beese LS. Структурные факторы, определяющие селективность высокоточной ДНК-полимеразы в отношении дезокси-, дидезокси- и рибонуклеотидов. Дж. Биол. Хим. 2012; 287:28215–28226. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Kunkel TA. Эволюция взглядов на (не)верность репликации ДНК. Колд-Спринг-Харбор Symp Quant Biol. 2009; 74: 91–101. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. DeLucia AM, Grindley ND, Joyce CM. Склонная к ошибкам ДНК-полимераза семейства Y (гомолог DinB из Sulfolobus solfataricus ) использует остаток «стерических ворот» для различения рибонуклеотидов. Нуклеиновые Кислоты Res. 2003; 31:4129–4137. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Moon AF, Garcia-Diaz M, Batra VK, Beard WA, Bebenek K, Kunkel TA, Wilson SH, Pedersen LC. Портрет семейства X: структурное понимание биологических функций полимераз семейства X. Восстановление ДНК (Амст) 2007; 6: 1709–1725. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Портрет семейства X: структурное понимание биологических функций полимераз семейства X. Восстановление ДНК (Амст) 2007; 6: 1709–1725. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Kumar D, Viberg J, Nilsson AK, Chabes A. Сильно мутагенные и сильно несбалансированные пулы dNTP могут не обнаруживаться контрольной точкой S-фазы. Нуклеиновые Кислоты Res. 2010;38:3975–3983. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Ник МакЭлхинни С.А., Уоттс Б., Кумар Д., Ватт Д.Л., Лундстрем Э.Б., Бургерс PMJ, Йоханссон Э., Чабес А., Кункель Т.А. Обильное включение рибонуклеотидов в ДНК репликативными полимеразами дрожжей. Proc Nat Acad Sci USA. 2010;107:4949–4954. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Traut TW. Физиологические концентрации пуринов и пиримидинов. Мол Селл Биохим. 1994; 140:1–22. [PubMed] [Google Scholar]
33. Ferraro P, Franzolin E, Pontarin G, Reichard P, Bianchi V. Количественное определение клеточных дезоксинуклеозидтрифосфатов. Нуклеиновые Кислоты Res. 2010;38:e85. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Нуклеиновые Кислоты Res. 2010;38:e85. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Ник МакЭлхинни С.А., Рамсден Д.А. Полимераза мю представляет собой ДНК-ориентированную ДНК/РНК-полимеразу. Мол Селл Биол. 2003; 23:2309–2315. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Kunkel TA, Burgers PM. Разделение нагрузки на репликационную вилку эукариот. Тенденции клеточной биологии. 2008; 18: 521–527. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Clausen AR, Zhang S, Burgers PM, Lee MY, Kunkel TA. Включение рибонуклеотидов, корректура и обход дельта-полимеразы ДНК человека. Восстановление ДНК (Амст) 2013; 12: 121–127. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Гоксенин А.Ю., Захуранчик В., ЛеКомпте К.Г., Таггарт Д.Дж., Суо З., Пурсел З.Ф. ДНК-полимераза эпсилон человека способна эффективно расширяться из нескольких последовательных рибонуклеотидов. Дж. Биол. Хим. 2012; 287:42675–42684. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Yao NY, Schroeder JW, Yurieva O, Simmons LA, O’Donnell ME. Стоимость дисбаланса пула rNTP/dNTP на вилке репликации. Proc Nat Acad Sci USA. 2013;110:12942–12947. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Yao NY, Schroeder JW, Yurieva O, Simmons LA, O’Donnell ME. Стоимость дисбаланса пула rNTP/dNTP на вилке репликации. Proc Nat Acad Sci USA. 2013;110:12942–12947. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Чабес А., Георгиева Б., Домкин В., Чжао X, Ротштейн Р., Теландер Л. Выживаемость при повреждении ДНК у дрожжей напрямую зависит от повышенных уровней dNTP, допускаемых ослабленным ингибированием рибонуклеотидредуктазы по обратной связи. Клетка. 2003; 112: 391–401. [PubMed] [Google Scholar]
40. Hakansson P, Hofer A, Thelander L. Регуляция восстановления рибонуклеотидов млекопитающих и пулов dNTP после повреждения ДНК и в покоящихся клетках. Дж. Биол. Хим. 2006; 281:7834–7841. [PubMed] [Google Scholar]
41. Коллинз К., Грейдер К.В. Использование рибонуклеотидов и РНК-праймеров теломеразой Tetrahymena. EMBO J. 1995;14:5422–5432. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Boule JB, Rougeon F, Papanicolaou C. Терминальная дезоксинуклеотидилтрансфераза без разбора включает рибонуклеотиды и дезоксирибонуклеотиды. Дж. Биол. Хим. 2001; 276:31388–31393. [PubMed] [Google Scholar]
Дж. Биол. Хим. 2001; 276:31388–31393. [PubMed] [Google Scholar]
43. Вайсман А., Кубан В., Макдональд Дж. П., Карата К., Ян В., Гудман М. Ф., Вудгейт Р. Критические аминокислоты в Escherichia coli UmuC, ответственные за различение сахаров и точность замещения оснований . Нуклеиновые Кислоты Res. 2012;40:6144–6157. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Эдер П.С., Уолдер Р.Ю., Уолдер Дж.А. Субстратная специфичность РНКазы h2 человека и ее роль в эксцизионной репарации остатков рибозы, неправильно включенных в ДНК. Биохимия. 1993; 75: 123–126. [PubMed] [Google Scholar]
45. Rydberg B, Game J. Иссечение ошибочно включенных рибонуклеотидов в ДНК с помощью РНКазы H (тип 2) и FEN-1 в бесклеточных экстрактах. Proc Nat Acad Sci USA. 2002; 99:16654–16659. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Cerritelli SM, Crouch RJ. Рибонуклеаза Н: ферменты эукариот. ФЕБС Дж. 2009;276:1494–1505. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Ник МакЭлхинни С.А., Кумар Д., Кларк А.Б., Ватт Д.Л., Уоттс Б.Е., Лундстром Э.Б., Йоханссон Э., Чабес А., Кункель Т.А. Нестабильность генома из-за включения рибонуклеотидов в ДНК. Nat Chem Biol. 2010; 6: 774–781. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ник МакЭлхинни С.А., Кумар Д., Кларк А.Б., Ватт Д.Л., Уоттс Б.Е., Лундстром Э.Б., Йоханссон Э., Чабес А., Кункель Т.А. Нестабильность генома из-за включения рибонуклеотидов в ДНК. Nat Chem Biol. 2010; 6: 774–781. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Miyabe I, Kunkel TA, Carr AM. Основные роли ДНК-полимераз эпсилон и дельта в эукариотической вилке репликации эволюционно законсервированы. Генетика PLoS. 2011;7:e1002407. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Лужан С.А., Уильямс Дж.С., Клаузен А.Р., Кларк А.Б., Кункель Т.А. Рибонуклеотиды являются сигналами для восстановления несоответствия ошибок репликации ведущей цепи. Мол Ячейка. 2013;50:437–443. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Гроссман Л.И., Уотсон Р., Виноград Дж. Наличие рибонуклеотидов в зрелой замкнутой митохондриальной ДНК. Proc Nat Acad Sci USA. 1973; 70: 3339–3343. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Reijns MA, Rabe B, Rigby RE, Mill P, Astell KR, Lettice LA, Boyle S, Leitch A, Keighren M, Kilanowski F, Devenney PS, Sexton Д. , Граймс Дж., Холт И.Дж., Хилл Р.Е., Тейлор М.С., Лоусон К.А., Дорин Дж.Р., Джексон А.П. Ферментативное удаление рибонуклеотидов из ДНК необходимо для целостности и развития генома млекопитающих. Клетка. 2012;149: 1008–1022. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Граймс Дж., Холт И.Дж., Хилл Р.Е., Тейлор М.С., Лоусон К.А., Дорин Дж.Р., Джексон А.П. Ферментативное удаление рибонуклеотидов из ДНК необходимо для целостности и развития генома млекопитающих. Клетка. 2012;149: 1008–1022. [Бесплатная статья PMC] [PubMed] [Google Scholar]
52. Kunkel TA. Высокая стоимость жизни. Тенденции Жене; Специальная конференция Американской ассоциации исследований рака: эндогенные источники мутаций; Форт-Майерс, Флорида, США. 11–15 ноября 1998 г.; 1999. С. 93–94. [PubMed] [Google Scholar]
53. Qiu J, Qian Y, Frank P, Wintersberger U, Shen B. Saccharomyces cerevisiae РНКаза H(35) действует при удалении РНК-праймера во время синтеза отстающей цепи ДНК, наиболее эффективно в сотрудничество с нуклеазой Rad27. Мол Селл Биол. 1999;19:8361–8371. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Garg P, Stith CM, Sabouri N, Johansson E, Burgers PM. Холостой ход ДНК-полимеразы дельта поддерживает лигируемый разрыв во время репликации отстающей цепи ДНК. Гены Дев. 2004; 18: 2764–2773. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Гены Дев. 2004; 18: 2764–2773. [Бесплатная статья PMC] [PubMed] [Google Scholar]
55. Williams JS, Clausen AR, Nick McElhinny SA, Watts BE, Johansson E, Kunkel TA. Корректировка рибонуклеотидов, встроенных в ДНК, с помощью дрожжевой ДНК-полимеразы эпсилон. Ремонт ДНК (Амст) 2012; 11: 649–656. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. Спаркс Дж.Л., Чон Х., Черрителли С.М., Кункель Т.А., Йоханссон Э., Крауч Р.Дж., Бургерс П.М. Эксцизионная репарация рибонуклеотидов, инициируемая РНКазой h3. Мол Ячейка. 2012;47:980–986. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Tumbale P, Williams JS, Schellenberg MJ, Kunkel TA, Williams RS. Апратаксин устраняет аденилированные соединения РНК-ДНК для поддержания целостности генома. Природа. 2014; 506:111–115. [Бесплатная статья PMC] [PubMed] [Google Scholar]
58. Sekiguchi J, Shuman S. Сайт-специфическая рибонуклеазная активность эукариотической ДНК-топоизомеразы I. Mol Cell. 1997; 1:89–97. [PubMed] [Google Scholar]
59. Kim N, Huang SN, Williams JS, Li YC, Clark AB, Cho JE, Kunkel TA, Pommier Y, Jinks-Robertson S. Мутагенная обработка рибонуклеотидов в ДНК дрожжевой топоизомеразой I . Наука. 2011; 332:1561–1564. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Kim N, Huang SN, Williams JS, Li YC, Clark AB, Cho JE, Kunkel TA, Pommier Y, Jinks-Robertson S. Мутагенная обработка рибонуклеотидов в ДНК дрожжевой топоизомеразой I . Наука. 2011; 332:1561–1564. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Williams JS, Smith DJ, Marjavaara L, Lujan SA, Chabes A, Kunkel TA. Опосредованное топоизомеразой 1 удаление рибонуклеотидов из зарождающейся ведущей цепи ДНК. Мол Ячейка. 2013;49: 1010–1015. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Вос С.М., Треттер Э.М., Шмидт Б.Х., Бергер Дж.М. Все запуталось: как клетки направляют, управляют и используют функцию топоизомеразы. Nat Rev Mol Cell Biol. 2011; 12:827–841. [Бесплатная статья PMC] [PubMed] [Google Scholar]
62. Phatnani HP, Jones JC, Greenleaf AL. Расширение функционального репертуара киназы I CTD и РНК-полимеразы II: новые белки, ассоциированные с фосфоCTD, в протеоме дрожжей. Биохимия. 2004; 43:15702–15719. [Бесплатная статья PMC] [PubMed] [Google Scholar]
63. Aguilera A, Garcia-Muse T. R петли: от побочных продуктов транскрипции до угроз стабильности генома. Мол Ячейка. 2012;46:115–124. [PubMed] [Google Scholar]
Aguilera A, Garcia-Muse T. R петли: от побочных продуктов транскрипции до угроз стабильности генома. Мол Ячейка. 2012;46:115–124. [PubMed] [Google Scholar]
64. Агилера А., Кляйн Х.Л. Генетический контроль внутрихромосомной рекомбинации у Saccharomyces cerevisiae . I. Выделение и генетическая характеристика гиперрекомбинационных мутаций. Генетика. 1988; 119: 779–790. [Бесплатная статья PMC] [PubMed] [Google Scholar]
65. Арана М.Э., Кернс Р.Т., Уэри Л., Герриш К.Е., Бушель П.Р., Кункель Т.А. Транскрипционные ответы на потерю РНКазы h3 у Saccharomyces cerevisiae . Ремонт ДНК (Амст) 2012; 11: 933–941. [Бесплатная статья PMC] [PubMed] [Google Scholar]
66. Lazzaro F, Novarina D, Amara F, Watt DL, Stone JE, Costanzo V, Burgers PM, Kunkel TA, Plevani P, Muzi-Falconi M. RNase H и восстановление после репликации защищают клетки от рибонуклеотидов, включенных в ДНК. Мол Ячейка. 2012;45:99–110. [Бесплатная статья PMC] [PubMed] [Google Scholar]
67. Kim N, Cho JE, Li YC, Jinks-Robertson S. Гибриды РНК:ДНК инициируют связанные с квазипалиндромом мутации в высоко транскрибируемой ДНК дрожжей. Генетика PLoS. 2013;9:e1003924. [Статья бесплатно PMC] [PubMed] [Google Scholar]
Kim N, Cho JE, Li YC, Jinks-Robertson S. Гибриды РНК:ДНК инициируют связанные с квазипалиндромом мутации в высоко транскрибируемой ДНК дрожжей. Генетика PLoS. 2013;9:e1003924. [Статья бесплатно PMC] [PubMed] [Google Scholar]
68. Vaisman A, McDonald JP, Huston D, Kuban W, Liu L, Van Houten B, Woodgate R. Удаление ошибочно включенных рибонуклеотидов из прокариотических геномов: неожиданная роль эксцизионная репарация нуклеотидов. Генетика PLoS. 2013;9:e1003878. [Бесплатная статья PMC] [PubMed] [Google Scholar]
69. McDonald JP, Vaisman A, Kuban W, Goodman MF, Woodgate R. Механизмы, используемые Escherichia coli для предотвращения включения рибонуклеотидов в геномную ДНК Pol V. PLoS Genet. 2012;8:e1003030. [Бесплатная статья PMC] [PubMed] [Google Scholar]
70. Vaisman A, McDonald JP, Noll S, Huston D, Loeb G, Goodman MF, Woodgate R. Изучение механизмов эксцизионной репарации рибонуклеотидов в Escherichia coli. Мутат Рез. 2014; 761:21–33. [Бесплатная статья PMC] [PubMed] [Google Scholar]
71. Калдекотт К.В. Молекулярная биология. Рибоза — внутренняя угроза ДНК. Наука. 2014; 343: 260–261. [PubMed] [Google Scholar]
Калдекотт К.В. Молекулярная биология. Рибоза — внутренняя угроза ДНК. Наука. 2014; 343: 260–261. [PubMed] [Google Scholar]
72. Hiller B, Achleitner M, Glage S, Naumann R, Behrendt R, Roers A. РНКаза млекопитающих h3 удаляет рибонуклеотиды из ДНК для поддержания целостности генома. J Эксперт Мед. 2012; 209:1419–1426. [Бесплатная статья PMC] [PubMed] [Google Scholar]
73. Clausen AR, Murray MS, Passer AR, Pedersen LC, Kunkel TA. Структурно-функциональный анализ обхода рибонуклеотидов репликазами ДНК семейства B. Proc Nat Acad Sci USA. 2013;110:16802–16807. [Бесплатная статья PMC] [PubMed] [Google Scholar]
74. Сторичи Ф., Бебенек К., Кункель Т.А., Горденин Д.А., Резник М.А. Репарация ДНК на основе РНК. Природа. 2007; 447: 338–341. [Бесплатная статья PMC] [PubMed] [Google Scholar]
75. Watt DL, Johansson E, Burgers PM, Kunkel TA. Репликация ДНК-матриц, содержащих рибонуклеотиды, репликативными полимеразами дрожжей. Восстановление ДНК (Амст) 2011; 10: 897–902. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
76. El Hage A, French SL, Beyer AL, Tollervey D. Потеря топоизомеразы I приводит к блокам транскрипции, опосредованным R-петлей, во время синтеза рибосомной РНК. Гены Дев. 2010; 24:1546–1558. [Бесплатная статья PMC] [PubMed] [Google Scholar]
77. Bermejo R, Lai MS, Foiani M. Предотвращение репликационного стресса для поддержания стабильности генома: разрешение конфликтов между репликацией и транскрипцией. Мол Ячейка. 2012;45:710–718. [PubMed] [Google Scholar]
78. Стетсон Д.Б., Ко Дж.С., Хайдманн Т., Меджитов Р. Trex1 предотвращает внутриклеточное инициирование аутоиммунитета. Клетка. 2008; 134: 587–598. [Бесплатная статья PMC] [PubMed] [Google Scholar]
79. Balk B, Maicher A, Dees M, Klermund J, Luke-Glaser S, Bender K, Luke B. Гибриды теломерной РНК и ДНК влияют на динамику длины теломер и старение. Nat Struct Mol Biol. 2013;20:1199–1205. [PubMed] [Google Scholar]
80. Askree SH, Yehuda T, Smolikov S, Gurevich R, Hawk J, Coker C, Krauskopf A, Kupiec M, McEachern MJ. Полногеномный скрининг делеционных мутантов Saccharomyces cerevisiae , влияющих на длину теломер. Proc Nat Acad Sci USA. 2004; 101:8658–8663. [Статья бесплатно PMC] [PubMed] [Google Scholar]
Полногеномный скрининг делеционных мутантов Saccharomyces cerevisiae , влияющих на длину теломер. Proc Nat Acad Sci USA. 2004; 101:8658–8663. [Статья бесплатно PMC] [PubMed] [Google Scholar]
81. Huertas P, Aguilera A. Котранскрипционно образованные гибриды ДНК: РНК опосредуют нарушение элонгации транскрипции и связанную с транскрипцией рекомбинацию. Мол Ячейка. 2003; 12: 711–721. [PubMed] [Академия Google]
82. Чон Х., Спаркс Д.Л., Рыхлик М., Новотны М., Бургерс П.М., Крауч Р.Дж., Черрителли С.М. Роль РНКазы h3 в целостности генома выявляется путем расцепления ее активности. Нуклеиновые Кислоты Res. 2013;41:3130–3143. [Бесплатная статья PMC] [PubMed] [Google Scholar]
83. Cho JE, Kim N, Li YC, Jinks-Robertson S. Два различных механизма зависимого от топоизомеразы 1 мутагенеза в дрожжах. Восстановление ДНК (Амст) 2013; 12: 205–211. [Бесплатная статья PMC] [PubMed] [Google Scholar]
84. Lippert MJ, Kim N, Cho JE, Larson RP, Schoenly NE, O’Shea SH, Jinks-Robertson S. Роль топоизомеразы 1 в транскрипционно-ассоциированном мутагенезе в дрожжах. Proc Nat Acad Sci USA. 2011;108:698–703. [PMC free article] [PubMed] [Google Scholar]
Роль топоизомеразы 1 в транскрипционно-ассоциированном мутагенезе в дрожжах. Proc Nat Acad Sci USA. 2011;108:698–703. [PMC free article] [PubMed] [Google Scholar]
85. Takahashi T, Burguiere-Slezak G, Van der Kemp PA, Boiteux S. Топоизомераза 1 провоцирует образование коротких делеций в повторяющихся последовательностях при высокой транскрипции у Saccharomyces cerevisiae . Proc Nat Acad Sci USA. 2011; 108: 692–697. [Статья PMC бесплатно] [PubMed] [Google Scholar]
86. Allen-Soltero SL, Martinez CD, Putnam RD, Kolodner A. Saccharomyces cerevisiae Рибонуклеаза H 2 Сеть взаимодействия функционирует для подавления нестабильности генома. Мол Селл Биол. 2014; 34:1521–1534. [Бесплатная статья PMC] [PubMed] [Google Scholar]
87. Кроу Ю.Дж., Лейтч А., Хейворд Б.Е., Гарнер А., Пармар Р., Гриффит Э., Али М., Семпл С., Айкарди Дж., Бабул-Хирджи Р., Бауманн С., Бакстер П., Бертини Э., Чандлер К.Е., Читаят Д. , Cau D, Dery C, Fazzi E, Goizet C, King MD, Klepper J, Lacombe D, Lanzi G, Lyall H, Martinez-Frias ML, Mathieu M, McKeown C, Monier A, Oade Y, Quarrell OW, Rittey CD , Роджерс Р. С., Санчис А., Стефенсон Дж.Б., Таке У., Тилль М., Толми Дж.Л., Томлин П., Войт Т., Веске Б., Вудс К.Г., Лебон П., Бонтрон Д.Т., Понтинг К.П., Джексон А.П. Мутации в генах, кодирующих субъединицы рибонуклеазы h3, вызывают синдром Айкарди-Гутьера и имитируют врожденную вирусную инфекцию головного мозга. Нат Жене. 2006;38:910–916. [PubMed] [Google Scholar]
С., Санчис А., Стефенсон Дж.Б., Таке У., Тилль М., Толми Дж.Л., Томлин П., Войт Т., Веске Б., Вудс К.Г., Лебон П., Бонтрон Д.Т., Понтинг К.П., Джексон А.П. Мутации в генах, кодирующих субъединицы рибонуклеазы h3, вызывают синдром Айкарди-Гутьера и имитируют врожденную вирусную инфекцию головного мозга. Нат Жене. 2006;38:910–916. [PubMed] [Google Scholar]
88. Ияма Т., Уилсон Д.М., 3-й механизм репарации ДНК в делящихся и неделящихся клетках. Восстановление ДНК (Амст) 2013; 12: 620–636. [Бесплатная статья PMC] [PubMed] [Google Scholar]
89. Brawley OW, Cornelius LJ, Edwards LR, Gamble VN, Green BL, Inturrisi C, James AH, Laraque D, Mendez M, Montoya CJ, Pollock BH, Robinson L, Scholnik AP, Schori M. Конференция по развитию консенсуса Национального института здравоохранения: лечение серповидно-клеточной анемии гидроксимочевиной. Энн Интерн Мед. 2008;148:932–938. [PubMed] [Google Scholar]
90. Sayrac S, Vengrova S, Godfrey EL, Dalgaard JZ. Идентификация нового типа спейсерного элемента, необходимого для импринтинга у делящихся дрожжей. Генетика PLoS. 2011;7:e1001328. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Генетика PLoS. 2011;7:e1001328. [Бесплатная статья PMC] [PubMed] [Google Scholar]
91. Dalgaard JZ. Причины и последствия включения рибонуклеотидов в ядерную ДНК. Тенденции Жене. 2012; 28: 592–597. [PubMed] [Google Scholar]
92. Nick McElhinny SA, Kissling GE, Kunkel TA. Дифференциальная коррекция ошибок репликации отстающих цепей, сделанных ДНК-полимеразами α и δ Proc Nat Acad Sci USA. 2010;107:21070–21075. [Бесплатная статья PMC] [PubMed] [Google Scholar]
93. Ghodgaonkar MM, Lazzaro F, Olivera-Pimentel M, Artola-Boran M, Cejka P, Reijns MA, Jackson AP, Plevani P, Muzi-Falconi M, Jiricny J. Рибонуклеотиды, ошибочно включенные в ДНК, действуют как сигналы дискриминации цепей в эукариотической репарации несоответствия. Мол Ячейка. 2013;50:323–332. [Бесплатная статья PMC] [PubMed] [Google Scholar]
94. Nandakumar J, Podell ER, Cech TR. Как теломерный белок POT1 избегает РНК для достижения специфичности к одноцепочечной ДНК. Proc Natl Acad Sci USA. 2010; 107: 651–656. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
95. Люк Б., Панза А., Редон С., Иглесиас Н., Ли З., Лингнер Дж. Экзонуклеаза Rat1p 5′-3′ расщепляет РНК, содержащую теломерные повторы, и способствует удлинению теломер в Saccharomyces cerevisiae . Мол Ячейка. 2008; 32: 465–477. [PubMed] [Google Scholar]
96. Dunn K, Griffith JD. Наличие двойной спирали РНК ингибирует ее взаимодействие с гистоновым белком. Нуклеиновые Кислоты Res. 1980; 8: 555–566. [Бесплатная статья PMC] [PubMed] [Google Scholar]
97. Hovatter KR, Martinson HG. Спиральное изменение ДНК, вызванное рибонуклеотидами, предотвращает образование нуклеосом. Proc Nat Acad Sci USA. 1987;84:1162–1166. [Бесплатная статья PMC] [PubMed] [Google Scholar]
98. Pursell ZF, Kunkel TA. ДНК-полимераза эпсилон: полимераза необычного размера (и сложности) Prog Nucleic Acid Res Mol Biol. 2008; 82: 101–145. [Бесплатная статья PMC] [PubMed] [Google Scholar]
99. Singh G, Klar AJ. Мутации в пути биосинтеза дезоксирибонуклеотидов вызывают распространение сайленсинга через гетерохроматиновые барьеры в области типа спаривания делящихся дрожжей.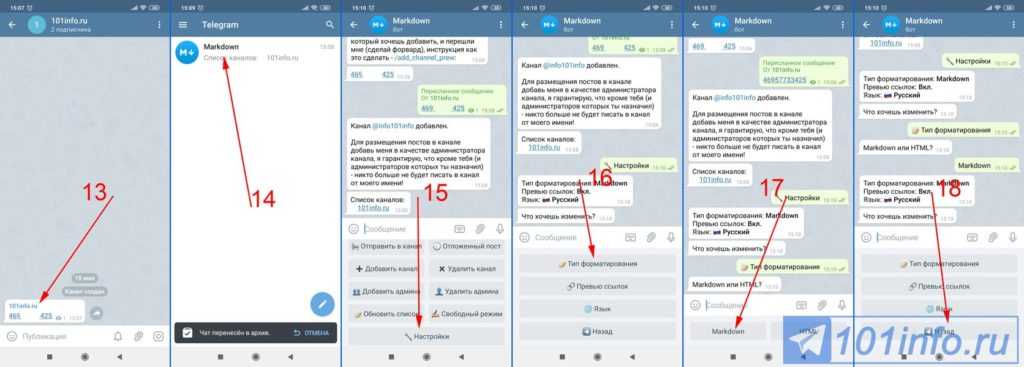 Дрожжи. 2008; 25:117–128. [PubMed] [Академия Google]
Дрожжи. 2008; 25:117–128. [PubMed] [Академия Google]
100. Kupfer PA, Leumann CJ. Химическая стабильность безосновной РНК по сравнению с безосновной ДНК. Нуклеиновые Кислоты Res. 2007; 35: 58–68. [Бесплатная статья PMC] [PubMed] [Google Scholar]
101. Bartlett EJ, Brissett NC, Doherty AJ. Рибонуклеолитическая резекция необходима для репарации смещенных цепей негомологичных промежуточных соединений концов. Proc Nat Acad Sci USA. 2013; 110:E1984–E1991. [Бесплатная статья PMC] [PubMed] [Google Scholar]
102. Vengrova S, Dalgaard JZ. Дикий тип Schizosaccharomyces pombe 9Импринт 0044 mat1 состоит из двух рибонуклеотидов. EMBO Rep. 2006; 7:59–65. [Бесплатная статья PMC] [PubMed] [Google Scholar]
103. Phizicky EM, Schwartz RC, Abelson J. Saccharomyces cerevisiae тРНК-лигаза. Очистка белка и выделение структурного гена. Дж. Биол. Хим. 1986; 261: 2978–2986. [PubMed] [Google Scholar]
104. Венгрова С., Далгаард Дж.З. Чувствительные к РНКазе модификации ДНК инициируют переключение типа спаривания S. pombe . Гены Дев. 2004;18:794–804. [Бесплатная статья PMC] [PubMed] [Google Scholar]
pombe . Гены Дев. 2004;18:794–804. [Бесплатная статья PMC] [PubMed] [Google Scholar]
105. Randerath K, Reddy R, Danna TF, Watson WP, Crane AE, Randerath E. Образование рибонуклеотидов в ДНК, модифицированной окислительным повреждением in vitro и in vivo. Характеристика по 32 П-постмаркировка. Мутат Рез. 1992; 275:355–366. [PubMed] [Google Scholar]
Рекомендации по применению сплавов для твердосплавных наплавок
Поиск
Подготовка поверхности
A. Удалите ржавчину, грязь, жир, масло и другие загрязнения со свариваемых поверхностей.
B. Требуется прочное основание, и это может потребовать удаления усталостного или прокатанного металла, высоких гребней или других крупных неровностей поверхности. Это может быть выполнено путем выдалбливания (Postalloy®250), шлифовки или механической обработки.
C. Трещины в основном металле должны быть выдолблены дугой или зашлифованы и отремонтированы с использованием совместимых электродов. Если трещины проходят через основной металл, убедитесь, что конец трещины удален путем сверления или резки на конце, прежде чем выдалбливать трещины.
Если трещины проходят через основной металл, убедитесь, что конец трещины удален путем сверления или резки на конце, прежде чем выдалбливать трещины.
Заделка трещин с помощью V-образной канавки
D. Предыдущий наплавочный материал следует удалить, если:
- Используемый тип неизвестен
- Используемый тип несовместим с новым покрытием
- Отложения пористые или содержат3 пустоты
- Отложения с сильными трещинами и деформациями
E. Если поверхность сильно упрочнена, перед наплавкой или наращиванием изношенного участка необходимо удалить около 1/8” (3 мм) нагартованной поверхности. Невыполнение этого требования может привести к отслаиванию валика сварного шва.
Дуговая строжка удаляет неровности поверхности, упрочненные поверхности или трещины.
F. Края должны быть закруглены, без острых краев. Это вызывает чрезмерное смешивание основного металла и сплава для твердосплавной наплавки.
G. Если перед наплавкой требуется наплавка, выберите наплавку, совместимую с составом основного металла. Никогда не используйте 7018 в качестве наращивания. Полярность сварки Полярность сварки сильно влияет на степень разбавления. Обратная полярность приводит к наплавке первого слоя, состоящего из 50% основного металла и 50% металла сварного шва. С другой стороны, прямая полярность приводит к меньшему проникновению и более благоприятному химическому составу отложений. Второй слой в любом случае будет производить химический состав, подходящий для износостойкости.
Выбор твердосплавного покрытия
A. Никогда не наносите мягкий, пластичный наплавленный металл или упрочняющий марганцевый сплав поверх более твердого и хрупкого упрочняющего сплава. Отложения могут отслаиваться и отслаиваться. Более мягкий сплав всегда следует наносить под более твердый сплав. Никогда не используйте 7018 в качестве прокладки или наращивания. Он не обладает твердостью и прочностью для наплавки.
B. Когда две металлические детали соприкасаются друг с другом, рекомендуется соблюдать следующие правила. Часть, которую легче всего заменить, или твердая поверхность, должна быть примерно на 10 пунктов мягче, чем та часть, с которой сложнее работать.
C. Никогда не используйте мягкую или низколегированную сталь с марганцем. Сварочный шов будет хрупким.
D. Если марганцевые детали необходимо ремонтировать повторно, например, молотки или железнодорожные крестовины и стрелки, нанесите один или два слоя Postalloy®2865-FCO (электрод 207) в первый раз, это очень полезно.
E. Чем более износостойким является наплавка и чем выше содержание сплава и твердость, тем выше будет склонность к перекрестным проверкам. Они появляются при охлаждении и обусловлены разной скоростью усадки твердого наплавочного материала и основного материала. Желательна регулярная проверка шаблонов, так как это уменьшит или даже устранит тенденцию к искажению. Эти трещины обычно не проникают в основной материал и не ослабляют связь с основанием. Трещины должны быть поперечными поперек сварного шва на расстоянии менее 1 дюйма друг от друга. Если нет, увеличьте скорость движения.
Трещины должны быть поперечными поперек сварного шва на расстоянии менее 1 дюйма друг от друга. Если нет, увеличьте скорость движения.
Твердость и количество слоев
Предельная толщина наплавки. Толстые наплавки могут быстро растрескиваться и разрушаться в процессе эксплуатации. Кроме того, по мере увеличения твердости наплавки из твердого сплава они становятся более хрупкими. Если сплав не был специально разработан и испытан для многослойных наплавок, следующие ориентиры могут быть полезными для определения количества слоев твердого покрытия, которые должны быть нанесены. Если необходимо нанести больше слоев, чем указано для сплава, сначала следует нанести наплавляемый материал.
Разбавление
Необходимо также учитывать разбавление, которое произойдет с основным металлом. Наплавленный металл представляет собой смесь присадочного металла и основного металла, и химический состав наплавленного металла будет зависеть от того, сколько каждого из них присутствует. Износостойкость снижается из-за сильного разбавления основного металла. Следующие рекомендации помогут свести к минимуму разбавление, что приведет к повышению износостойкости.
Износостойкость снижается из-за сильного разбавления основного металла. Следующие рекомендации помогут свести к минимуму разбавление, что приведет к повышению износостойкости.
1. Не используйте чрезмерный сварочный ток.
2. Направьте дугу на расплавленный металл шва, а не на основной металл.
3. Используйте близкое перекрытие (от 50 до 75 %) при размещении сварных швов рядом друг с другом.
4. По возможности используйте прямую полярность постоянного тока (отрицательный электрод).
5. Не используйте чрезмерный предварительный нагрев. Предварительно нагрейте рекомендуемые диапазоны.
6. Независимо от стрингера или широкого плетения, скорость перемещения должна быть отрегулирована так, чтобы дуга направлялась на сварочную ванну.
7. При использовании проволочных процессов более длинный вылет уменьшит проникновение.
8. В порядке убывания проникновения и разбавления — вертикальный вверх (самый высокий), горизонтальный, вверх по склону, плоский и вниз по склону (самый низкий).
Предварительный нагрев
Марганцевая сталь.
Марганец предварительно не нагревать. Жесткие свойства марганца могут быть потеряны, если основной металл постоянно нагревается выше 500°F (260°C). Наплавленные швы должны быть распределены таким образом, чтобы избежать концентрированного и продолжительного подвода тепла в одну зону.
Чугун.
Чугун требует высоких температур предварительного нагрева для наплавки. Хорошее эмпирическое правило — тусклый красный цвет.
Углеродистые и низколегированные стали.
Предварительный нагрев некоторых углеродистых и низколегированных сталей может потребоваться для минимизации деформации, выкрашивания, растрескивания под валиком и растрескивания в основном металле. На температуру предварительного нагрева влияют содержание углерода и сплава, размер и жесткость детали. Чем выше содержание углерода и сплава, тем выше необходимая температура предварительного нагрева. Обратитесь к таблице предварительного нагрева или позвоните в Postle Industries для получения рекомендаций. Предварительный нагрев должен быть равномерным по всей детали, и деталь должна медленно охлаждаться.
Обратитесь к таблице предварительного нагрева или позвоните в Postle Industries для получения рекомендаций. Предварительный нагрев должен быть равномерным по всей детали, и деталь должна медленно охлаждаться.
Амортизирующие и буферные слои
Сплавы для наплавки обычно намного тверже и имеют гораздо более высокое содержание легирующих элементов, чем основной металл. Применение амортизирующего или буферного слоя обеспечивает переход между более мягким основным металлом и твердым покрытием.
Амортизирующий слой имеет несколько назначений
1. Большинство твердосплавных наплавок ограничиваются двумя или тремя слоями, некоторые только одним. Поэтому в некоторых приложениях требуется, чтобы промежуточный слой использовался для создания детали, близкой к чистовым размерам, перед нанесением более твердого, более стойкого к истиранию сплава.
2. Когда твердые материалы используются на мягких основных металлах, таких как мягкая сталь, существует тенденция к тому, чтобы слой твердого сплава «утопал» в мягком основном металле в условиях высоких нагрузок. Это может привести к отслаиванию сплава для твердосплавной наплавки. Промежуточный буферный слой поможет этого не допустить.
Это может привести к отслаиванию сплава для твердосплавной наплавки. Промежуточный буферный слой поможет этого не допустить.
3. Наплавочные сплавы чек-трещины по всему месторождению. Буферный слой помогает предотвратить распространение этих трещин в основной металл.
4. Если состояние поверхности связано с термоциклированием, большие различия в тепловых свойствах основного металла и наплавки могут привести к усталостным проблемам и растрескиванию. Нанесение буферного слоя обеспечивает очень эффективный переход между сварным швом и наплавкой.
5. Никогда не используйте 7018 в качестве прокладки или наращивания. Он не обладает твердостью и прочностью для наплавки.
Сплавы этой категории используются во многих различных деталях и компонентах
Наплавка на кромку
Когда кромка подвергается ударам или ударам, подготовка имеет решающее значение. Предлагаются следующие конструкции. Следует избегать острых углов, где могут образоваться трещины от напряжения.


 бесканальная печь
бесканальная печь (2,5х8,5 кирпича)
(2,5х8,5 кирпича)